
引言
奧泰康助力醫工結合創新轉化產品「一體式人工血管術中支架系統」獲批——開啟A型主動脈夾層治療新紀元2025年4月9日,由北京華脈泰科醫療器械股份有限公司和中國醫學科學院阜外醫院于存濤教授合作研發的創新產品【一體式人工血管術中支架系統】通過國家藥品監督管理局(NMPA)注冊審核,獲得第三類醫療器械注冊證(國械注準20253130730)。奧泰康依托MA市場準入全流程解決方案助力產品上市。
市場準入全流程服務,為醫療成果落地賦能
將一個臨床需求轉化為醫療器械產品并最終獲批上市受益臨床,是一個涉及多學科協作、多方協同、嚴格執行SOP流程和法規監管的復雜過程。產品的獲批不僅意味著這項醫工結合的技術獲得業界認可,同時也充分展現了奧泰康在創新及高端醫療器械CRO服務領域的卓越實力和專業承諾,再一次實現了創新三類高風險植入類器械服務領域的里程碑式跨越。在此次合作中,奧泰康發揮其在臨床注冊服務領域的優勢,為該醫療器械項目配備了專業的臨床執行團隊,嚴格遵循國家相關法規和標準執行,確保試驗數據的科學性、準確性和可靠性。

△臨床試驗方案討論會現場
項目在疫情期間開展,臨床試驗方面,執行團隊面臨參研中心無法提供人員跟臺,執行團隊隨時面臨疫情封控的風險,以及受試者入院入組和正常隨訪的挑戰,通過多方高效協作,最大限度保障臨床試驗進度不受影響。
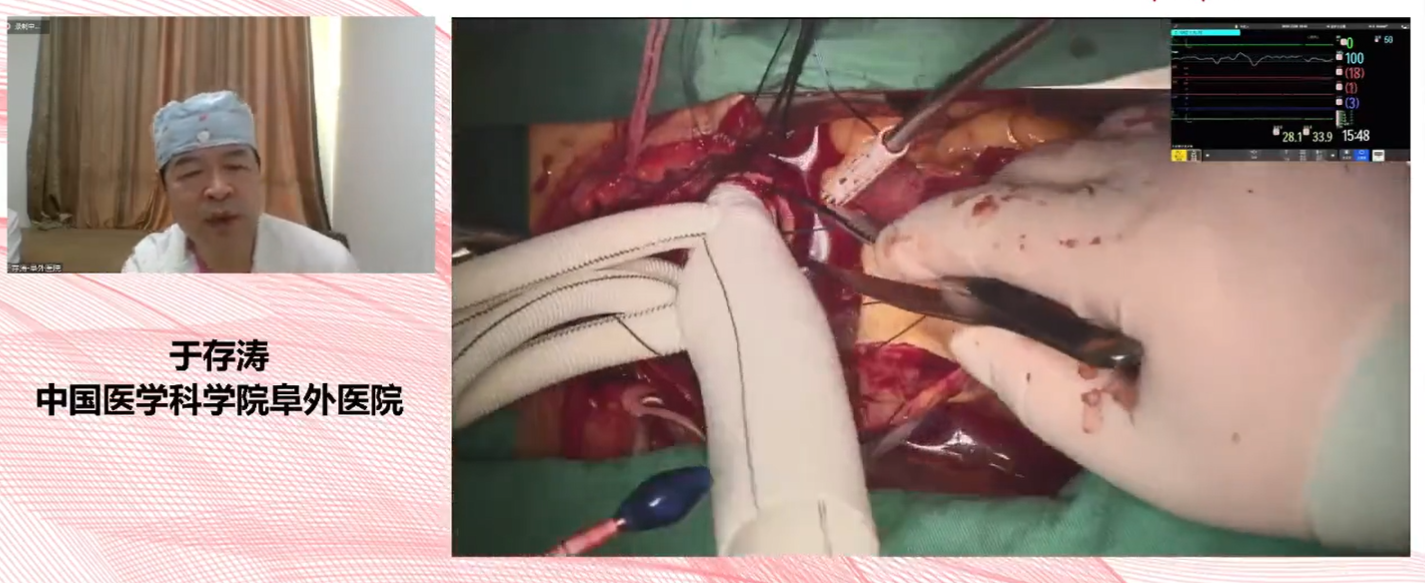
△于存濤教授手術教學指導現場
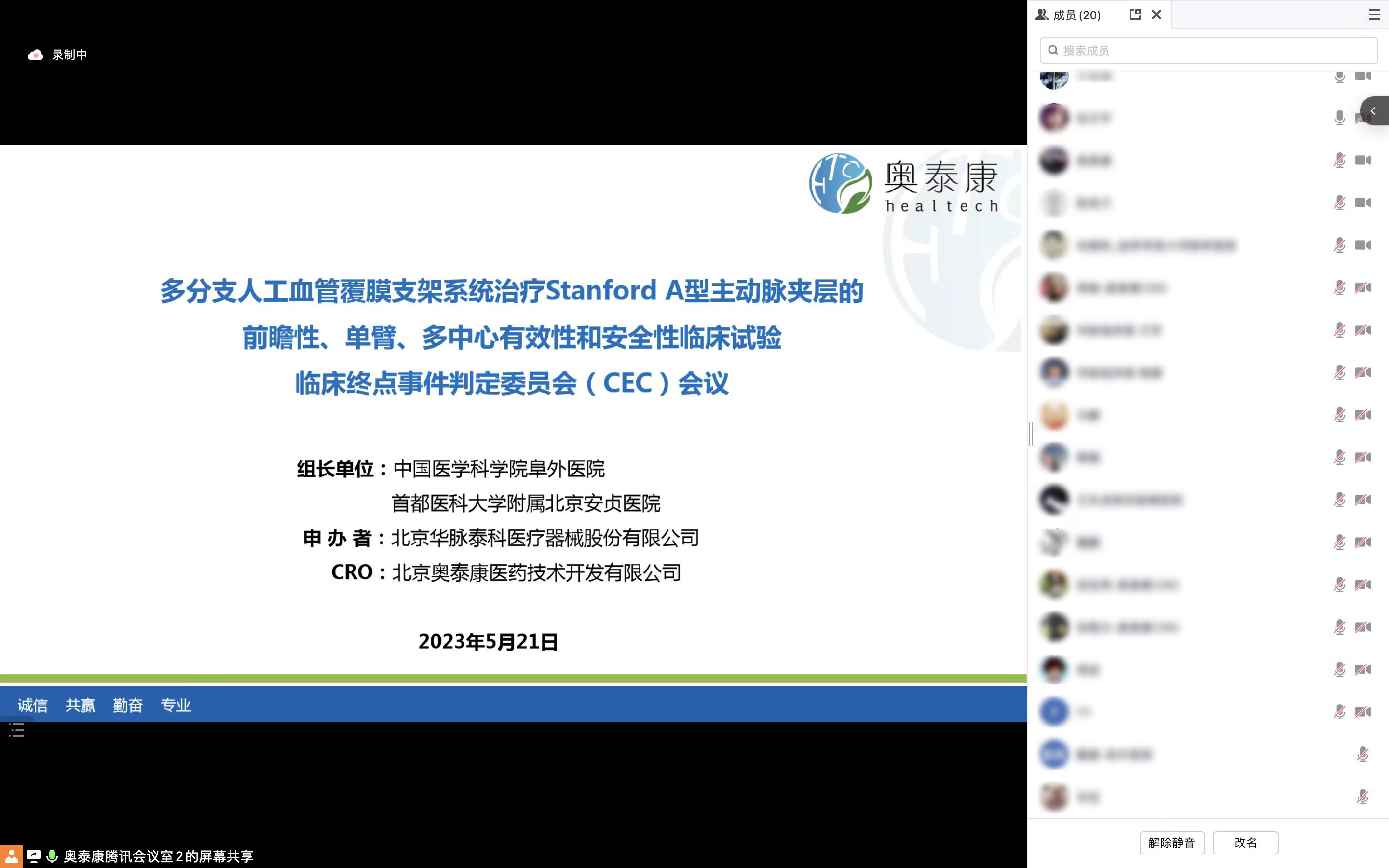
△臨床終點事件判定委員會(CEC)線上會議
奧泰康團隊從產品創新申報、臨床試驗、CEC審評會議、注冊發補咨詢、產品風險獲益分析等環節助力產品上市。
獲批時間軸
01
2019年10月
探索性試驗首例受試者入組
02
2019年11月
臨床試驗方案討論會
03
2020年4月
召開創新審查答辯會
通過創新審批
04
2020年8月
FIM試驗第一例受試者入組
05
2022年6月
最后一例受試者入組
06
2023年5月
召開臨床終點事件判定委員會(CEC)會議
07
2024年1月
提交產品注冊申請
08
2025年4月
產品獲國家藥監局批準上市
攜手并進·再創輝煌
全球首創的創新醫療器械華脈·心岸®一體式人工血管術中支架系統,自中國醫學科學院阜外醫院于存濤教授2008年提出產品概念到產品研發直至上市,歷經十余年,標志著我國在主動脈疾病治療領域取得重大突破,是醫工結合科研成果轉化的成功案例,也是奧泰康在創新及高端醫療器械全流程解決方案實力的又一次彰顯。衷心祝賀我們的客戶企業取得國家藥監局評審許可,也感謝參研中心及合作伙伴的全程支持與配合,我們也將以此為契機,始終堅持服務質量的底線,期待未來奧泰康能夠推動更多優質產品進入市場。
